(腎細胞癌に対する承認内容)
バベンチオ®効能又は効果:根治切除不能又は転移性の腎細胞癌
臨床成績
JAVELIN Renal 101試験:国際共同第Ⅲ相試験(B9991003試験)1)2)3)4)
PD-L1陽性患者集団(FAS)における無増悪生存期間(PFS)*1[主要評価項目]1)2)3)(PFS最終及び追加解析時点)
PFS最終解析時点でPD-L1陽性患者集団におけるPFSにおいて、バベンチオ®+アキシチニブ群のスニチニブ群に対する優越性が検証されました〔層別*ハザード比0.61(95%信頼区間:0.475,0.790)、p<0.0001[層別log-rank検定(片側有意水準:<0.001)]〕。PFS最終解析のデータカットオフ時点(2018年6月20日)におけるPFSイベント件数(%)はバベンチオ®+アキシチニブ群が108件(40.0%)、スニチニブ群が145件(50.0%)であり、PFS中央値はそれぞれ13.8ヵ月(95%信頼区間:11.1ヵ月,推定不能)、7.2ヵ月(95%信頼区間:5.7ヵ月,9.7ヵ月)でした。
さらに、PFS追加解析のデータカットオフ時点(2019年1月28日)における層別*ハザード比は0.62(95%信頼区間:0.490,0.777)でした。PFSイベント件数(%)はバベンチオ®+アキシチニブ群が138件(51.1%)、スニチニブ群が171件(59.0%)であり、PFS中央値はバベンチオ®+アキシチニブ群では13.8ヵ月(95%信頼区間:10.1ヵ月,20.7ヵ月)、スニチニブ群では7.0ヵ月(95%信頼区間:5.7ヵ月,9.6ヵ月)でした。
](/rcc/images/clinicaltrial/response_01.jpg)
PD-L1陽性患者集団(FAS)における全生存期間(OS)[主要評価項⽬] 1)2)3)(OS中間解析1及び2回⽬時点)
PD-L1陽性患者集団における死亡はOS中間解析1回目時点で81例、OS中間解析2回目時点で145例であり、PD-L1陽性患者集団におけるOSの中間解析1回目及び中間解析2回目の結果、有意な延長は認められませんでした。
全患者集団(FAS)における無増悪生存期間(PFS)*1[重要な副次評価項目]1)2)3)(PFS最終及び追加解析時点)
事前に規定したゲート・キーピング法に従い、PD-L1陽性患者集団のPFSで有意差が認められたことから、続いて全患者集団のPFSを評価しました。PFS最終解析時点でPD-L1発現を問わない全患者集団におけるPFSにおいて、バベンチオ®+アキシチニブ群のスニチニブ群に対する優越性が検証されました〔層別*ハザード比0.69(95%信頼区間:0.563,0.840)、 p=0.0001[層別log-rank検定(片側有意水準:<0.001)]〕。PFS最終解析のデータカットオフ時点(2018年6月20日)におけるPFSイベント件数(%)はバベンチオ®+アキシチニブ群が180件(40.7%)、スニチニブ群が216件(48.6%)であり、PFS中央値はそれぞれ13.8ヵ月(95%信頼区間:11.1ヵ月,推定不能)、8.4ヵ月(95%信頼区間:6.9ヵ月,11.1ヵ月)でした。さらに、PFS追加解析のデータカットオフ時点(2019年1月28日)における層別*ハザード比は0.69(95%信頼区間:0.574,0.825)でした。PFSイベント件数(%)はバベンチオ®+アキシチニブ群が229件(51.8%)、スニチニブ群が258件(58.1%)であり、PFS中央値はバベンチオ®+アキシチニブ群では13.3ヵ月(95%信頼区間:11.1ヵ月,15.3ヵ月)、スニチニブ群では8.0ヵ月(95%信頼区間:6.7ヵ月,9.8ヵ月)でした。
](/rcc/images/clinicaltrial/response_02.jpg)
*:ECOG PS(0又は1)及び地域(米国、カナダ/西欧、その他の地域)による層別
全患者集団(FAS)における全生存期間(OS)[重要な副次評価項目]1)2)3)(OS中間解析1及び2回目時点)
事前に規定したゲート・キーピング法に従い、全患者集団のPFSで有意差が認められたことから、続いて全患者集団のOSを評価しました。全患者集団における死亡はOS中間解析1回目時点で138例、OS中間解析2回目時点で238例であり、全患者集団におけるOSの中間解析1回目及び中間解析2回目の結果、有意な延長は認められませんでした。
PD-L1陽性患者集団(FAS)におけるPFSの背景因⼦別サブグループ解析
(主要評価項⽬のサブグループ解析
*1)1)2) (PFS最終解析時点)
![「PD-L1陽性患者集団における全生存期間(OS)[主要評価項目]」のタイトルの下に以下の 文章を追加](/rcc/images/clinicaltrial/response_07.jpg)
*1:部分集団解析であり、優位性を示す解析ではない
*2:層別因子を考慮していない
全患者集団(FAS)におけるPFSのサブグループ解析
(重要な副次評価項目のサブグループ解析*1)1)2)(PFS最終解析時点)
全患者集団の地域、併合地域、人種別PFSについて、バベンチオ®+アキシチニブ及びスニチニブ群のハザード比は以下のとおりでした。
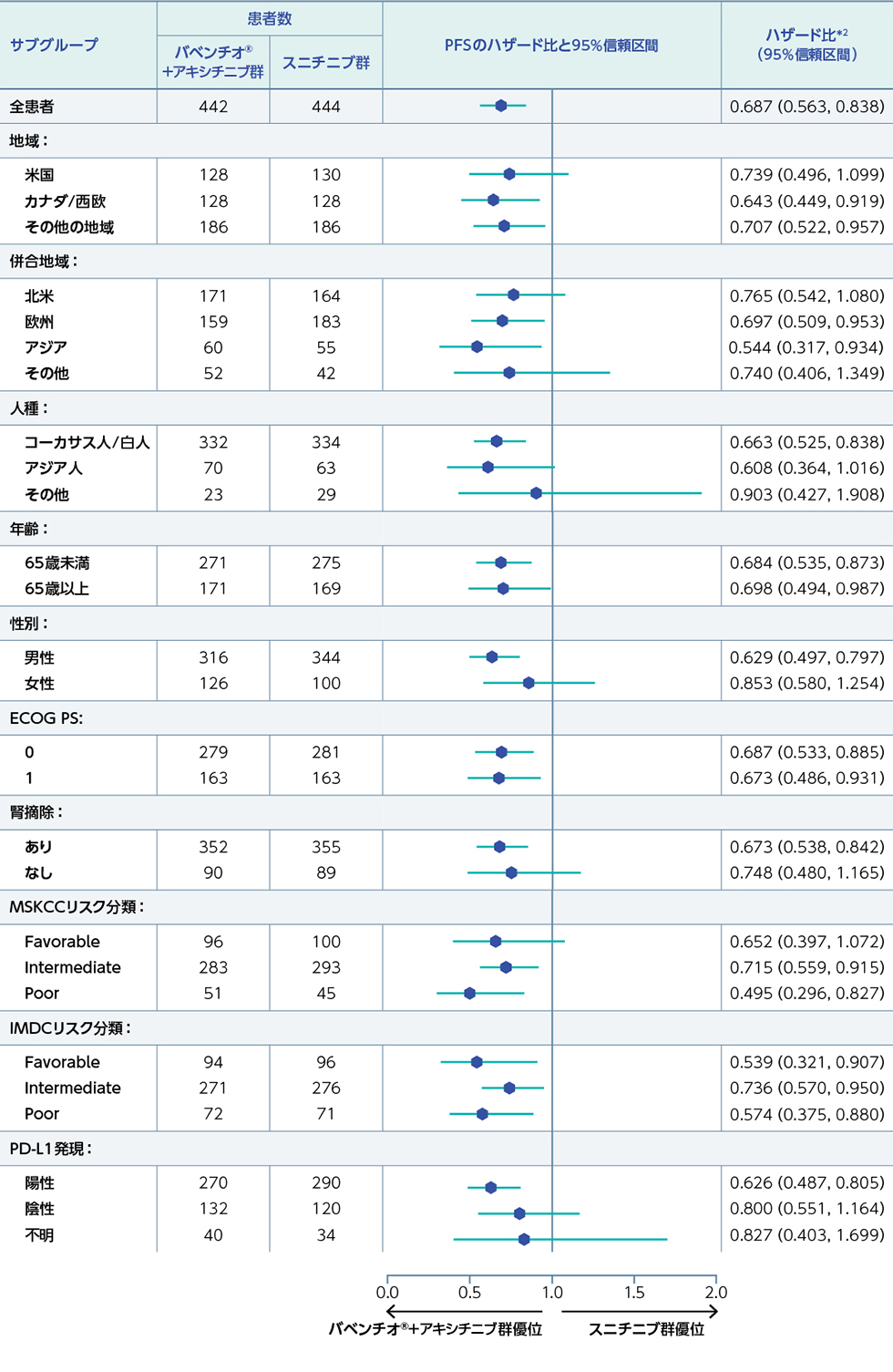
*1:部分集団解析であり、優位性を示す解析ではない。
*2:層別因子を考慮していない。
PDーL1の発現状況別のPFS(ITT)1)2)4)(PFS最終解析時点)
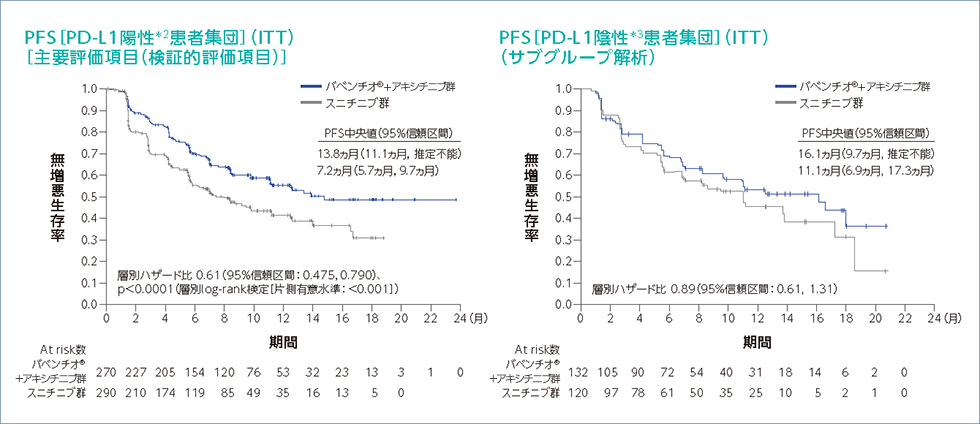
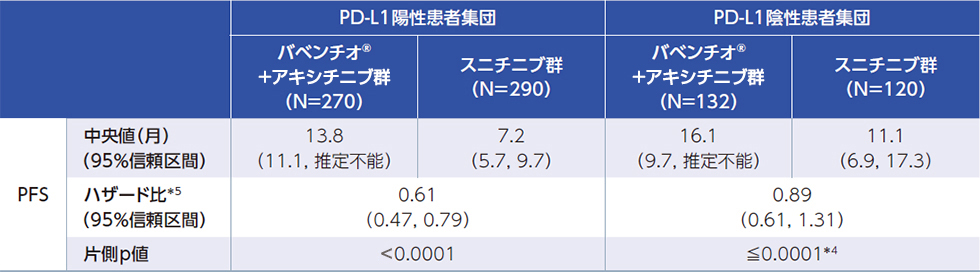
*1:RECIST v1.1に基づく盲検下での独立中央判定による評価
*2:PD-L1発現率1%以上
*3:PD-L1発現率1%未満
*4:ECOG-PS(0又は1)及び地域(米国、カナダ/西欧、その他の地域)を層別因子とした層別Cox比例ハザードモデル
PD-L1陽性患者集団(FAS)及び全患者集団(FAS)における客観的奏効(OR)*1
[その他の副次評価項目]1)2)3)(PFS最終及び追加解析時点)
PFS最終解析時点(データカットオフ日:2018年6月20日)のPD-L1陽性患者集団におけるORRは、バベンチオ®+
アキシチニブ群は55.2%、スニチニブ群は25.5%で、層別オッズ比*2は3.732(95%信頼区間:2.532,5.371)でした。
また、全患者集団におけるORRは、バベンチオ®+アキシチニブ群は51.4%、スニチニブ群は25.7%で、層別オッズ比
は3.098(95%信頼区間:2.300,4.148)でした。
PFS追加解析時点(データカットオフ日:2019年1月28日)のPD-L1陽性患者集団におけるORRは、バベンチオ®+
アキシチニブ群は55.9%、スニチニブ群は27.2%で、層別オッズ比は3.507(95%信頼区間:2.391,5.026)でした。
また、全患者集団におけるORRは、バベンチオ®+アキシチニブ群は52.5%、スニチニブ群は27.3%で、層別オッズ比
は2.996(95%信頼区間:2.230,3.998)でした。
![PD-L1陽性患者集団及び全患者集団における客観的奏効率(ORR)[その他の副次評価項目]](/rcc/images/clinicaltrial/response_04.jpg)
*1︓RECIST v1.1に基づく盲検下での独⽴中央判定による評価
*2︓ECOG PS(0⼜は1)及び地域(⽶国、カナダ/⻄欧、その他の地域)による層別
全患者集団(FAS)における奏効までの期間(TTR)及び奏効期間(DR)[その他の副次評価項目]1)2)3)
(PFS最終及び追加解析時点)
PFS最終解析時点(2018年6月20日)の全患者集団におけるTTRの中央値は、バベンチオ®+アキシチニブ群で2.6ヵ月、スニチニブ群で3.2ヵ月でした。両群ともDRの中央値は未達でした。
さらに、PFS追加解析時点(2019年1月28日)の全患者集団におけるTTRの中央値は、バベンチオ®+アキシチニブ群で2.7ヵ月、スニチニブ群で4.0ヵ月でした。DRの中央値はバベンチオ®+アキシチニブ群で18.5ヵ月、スニチニブ群で未達でした。
![全患者集団における奏効までの期間(TTR)及び奏効期間(DR)[その他の副次評価項目]](/rcc/images/clinicaltrial/response_08.jpg)
*1︓全患者集団において客観的奏効(CR又はPR)が認められた患者
*2︓Kaplan-Meier法で推定
全患者集団(FAS)におけるORR[その他の副次評価項目]1)2)(PFS最終解析時点)
バベンチオ®+アキシチニブ群とスニチニブ群におけるORRは、全患者集団ではそれぞれ51.4%、25.7%でした。
![全患者集団におけるORR[その他の副次評価項目]](/rcc/images/clinicaltrial/response_05.jpg)
全患者集団(FAS)におけるORRのサブグループ解析(その他の副次評価項目のサブグループ解析*1)1)2)
(PFS最終解析時点)
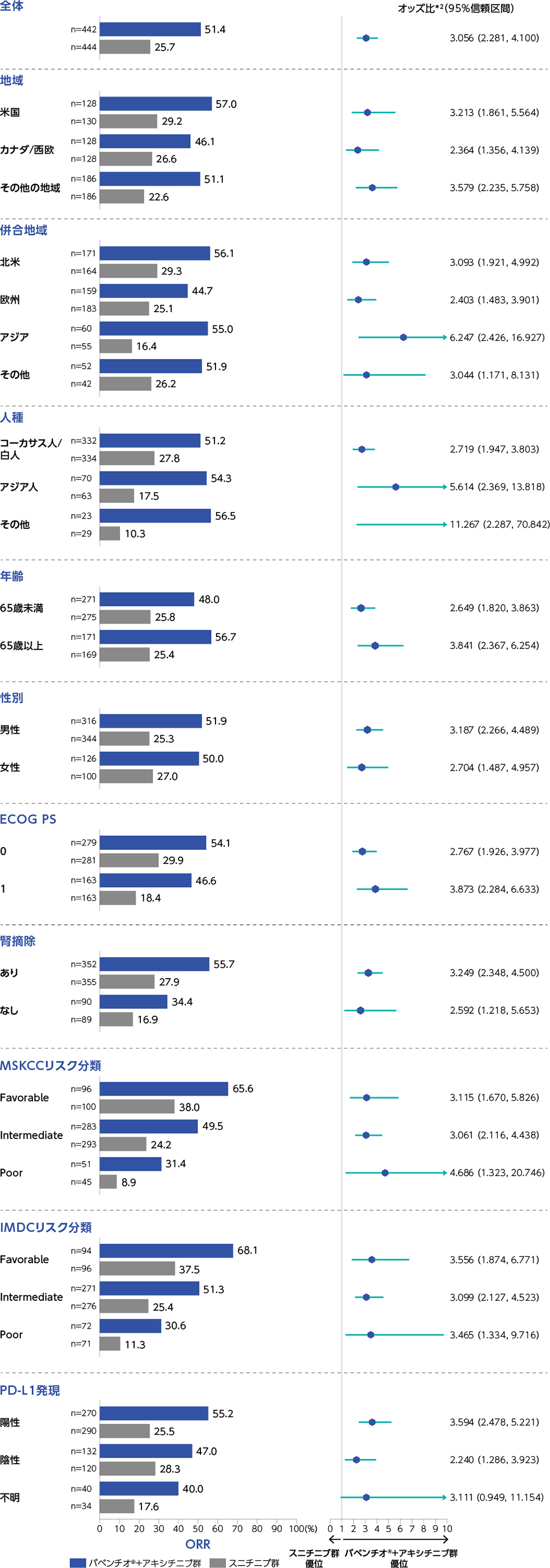
*1:部分集団解析であり、優位性を示す解析ではない。
*2:層別因子を考慮していない。
PFS2(FAS)[その他の副次評価項⽬](PFS最終及び追加解析時点)
本試験では、一次治療の効果が二次治療の効果に影響を与えるかどうかを検討するため、PFS2をその他の副次評価項目に含めました。PFS2は、無作為割り付けから、最初のPD(治験責任医師判定)後に開始した二次治療を中止するまで、二次治療開始後に認められた2回目のPD(治験責任医師判定)まで、あるいは死亡(死因を問わない)までのいずれか最も早い日までの期間と定義しました。
PFS最終解析時点で全患者集団のPFS2中央値はバベンチオ®+アキシチニブ群で未達、スニチニブ群で18.4ヵ⽉でした。
さらに、PFS追加解析時点で全患者集団のPFS2中央値はバベンチオ®+アキシチニブ群で未達、スニチニブ群で19.4ヵ⽉でした。
※次治療としての抗癌剤については、こちらをご参照ください。
安全性(安全性解析対象集団)(PFS最終解析)
-
バベンチオ®+アキシチニブ併用投与を受けた434例(日本人*133例を含む)中414例(95.4%)に副作用が認められました。主な副作用は、下痢235例(54.1%)、高血圧208例(47.9%)、疲労156例(35.9%)、手掌・足底発赤知覚不全症候群144例(33.2%)、発声障害116例(26.7%)、悪心107例(24.7%)、甲状腺機能低下症105例(24.2%)、口内炎96例(22.1%)、食欲減退86例(19.8%)でした。
スニチニブ単独投与を受けた439例(日本人*1 34例を含む)中423例(96.4%)に副作用が認められました。
主な副作用は、下痢196例(44.6%)、疲労159例(36.2%)、手掌・足底発赤知覚不全症候群148例(33.7%)、悪心148例(33.7%)、高血圧142例(32.3%)、味覚異常141例(32.1%)、食欲減退115例(26.2%)、口内炎100例(22.8%)、好中球減少症79例(18.0%)でした。 - 重篤な副作用は、バベンチオ®+アキシチニブ群で74例(17.1%)に認められ、主な重篤な副作用は下痢が6例(1.4%)、注入に伴う反応及び呼吸困難が各4例(0.9%)、発熱、副腎不全、急性腎障害及び不明が各3例(0.7%)等でした。同様に、スニチニブ群で57例(13.0%)に認められ、主な重篤な副作用は発熱、急性腎障害及び貧血が各5例(1.1%)、嘔吐及び腹痛が各4例(0.9%)、悪心及び血小板減少症が各3例(0.7%)等でした。
-
治験薬の投与中止に至った副作用において、バベンチオ®+アキシチニブ群でいずれかの治験薬の投与中止が80例(18.4%)で、その内訳は、アラニンアミノトランスフェラーゼ増加が17例(3.9%)、アスパラギン酸アミノトランスフェラーゼ増加が11例(2.5%)、注入に伴う反応が8例(1.8%)、不明が3例(0.7%)等でした。
バベンチオ®の投与中止が64例(14.7%)で、その内訳は、アラニンアミノトランスフェラーゼ増加が14例(3.2%)、アスパラギン酸アミノトランスフェラーゼ増加が9例(2.1%)、注入に伴う反応が8例(1.8%)、不明が3例(0.7%)等でした。
アキシチニブの投与中止が35例(8.1%)で、その内訳は、アラニンアミノトランスフェラーゼ増加が4例(0.9%)、アスパラギン酸アミノトランスフェラーゼ増加及び不明が各3例(0.7%)等でした。
スニチニブ群の投与中止が35例(8.0%)で、その内訳は、手掌・足底発赤知覚不全症候群4例(0.9%)、疲労、脳血管障害、蛋白尿、急性腎障害及び悪心が各2例(0.5%)等でした。
なお、データカットオフ時点で、バベンチオ®+アキシチニブ群とスニチニブ群における死亡はそれぞれ63例(14.5%)、75例(17.1%)に認められ、治験薬の毒性による死亡はそれぞれ3例(0.7%、内訳:突然死1例、心筋炎1例、壊死性膵炎1例)、1例(0.2%、内訳:腸管穿孔1例)でした。
(効能又は効果追加承認時)
*1:日本の治験実施施設で治験に参加した患者(全患者集団に中国人1例、その他のアジア人1例を含む)
安全性(PFS追加解析時点)
論文中に安全性に関する記載がありませんでした。電子添文の安全性情報をご参照ください。
1)社内資料:国際共同第Ⅲ相試験(B9991003試験)承認時評価資料
2)Motzer, R.J. et al.:N Engl J Med 380(12):1103, 2019 本試験は、Merck KGaA及びPfizer
INC.のスポンサーシップのもと、実施されました。
3)Choueiri, T.K. et al.:Ann Oncol 31(8):1030, 2020 本試験は、Merck KGaA及びPfizer
Inc.のスポンサーシップのもと、実施されました。
4)独⽴⾏政法⼈医薬品医療機器総合機構令和元年10⽉15⽇バベンチオ点滴静注200mg メルクバイオファーマ株式会社審査報告書
2023年7月 JP-AVE-00411




