(尿路上皮癌に対する承認内容)
バベンチオ®の効能又は効果:根治切除不能な尿路上皮癌における化学療法後の維持療法
臨床成績
JAVELIN Bladder 100試験:国際共同第Ⅲ相試験(B9991001試験)1)2)
試験デザイン
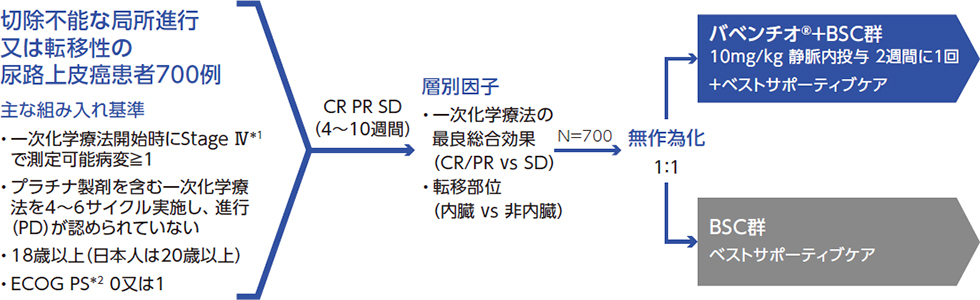
*1:American Joint Committee on Cancer(第7版)に基づくTNM分類
*2:ECOG PS:Eastern Cooperative Oncology Groupパフォーマンスステータス


*3:尿路上皮癌に対する効能又は効果については本邦未承認
*4:最大の解析対象集団(FAS)には以下に示す二つの主要UC患者集団の患者がすべて含まれ、すべての有効性評価項目及び患者背景の主要な解析対象集団とした。
- 1. 無作為化されたすべての患者(全患者集団)
- 2. 無作為化された患者のうち、PD-L1 IHC検査によりPD-L1陽性腫瘍(腫瘍浸潤免疫細胞を含む)を有すると判定された患者(PD-L1陽性患者集団)
*5:PD-L1陽性の判定は、Ventana SP263アッセイを用いて、下記条件のいずれかを満たす場合とした。
- ・腫瘍細胞の25%以上に膜染色が認められる
- ・腫瘍に浸潤した免疫細胞の割合が1%超かつ免疫細胞の25%以上に染色が認められる
- ・腫瘍に浸潤した免疫細胞の割合が1%かつ免疫細胞の100%に染色が認められる
*6:ジフェンヒドラミン塩酸塩25~50mg及びアセトアミノフェン500~650mgの静脈内投与又は同等の経口投与など。
*7:ただしコルチコステロイドの全身投与は不可とする。
*8:PFSと抗腫瘍効果の評価はRECIST v1.1に基づく盲検下独立中央判定及び治験責任医師判定を用いて行った。
*9:中間解析で実際に観察されたイベント数(全患者集団:324例(76.2%)、PD-L1陽性患者集団:143例(65.3%))に基づいてそれぞれ算出した。
*10:多重性を調整していないため、統計学的有意性の有無の判断は行えない。
患者背景
ベースライン時の人口統計学的特性及び疾患特性(FAS)
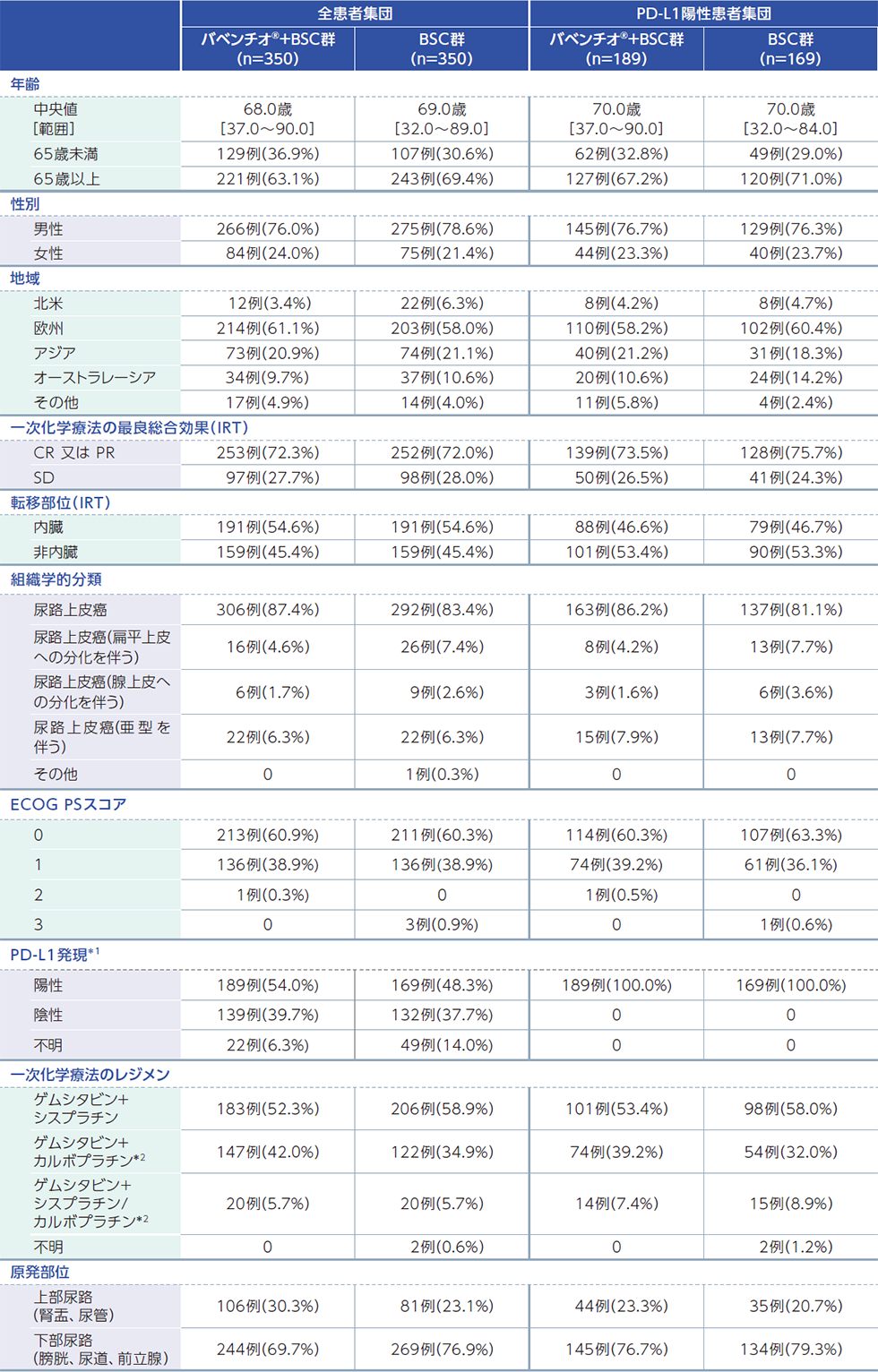
*1:PD-L1陽性の判定は、Ventana SP263アッセイを用いて、下記条件のいずれかを満たす場合とした。
- ・腫瘍細胞の25%以上に膜染色が認められる
- ・腫瘍に浸潤した免疫細胞の割合が1%超かつ免疫細胞の25%以上に染色が認められる
- ・腫瘍に浸潤した免疫細胞の割合が1%かつ免疫細胞の100%に染色が認められる
*2: 尿路上皮癌に対する効能又は効果については本邦未承認
1)社内資料:国際共同第Ⅲ相試験(B9991001試験)(2021年2月承認)承認時評価資料
2)Powles, T. et al. : N Engl J Med 383(13): 1218, 2020
本試験は、Merck及びPfizerの提携の一部として、Pfizerのスポンサーシップのもと実施されました。
2023年7月 JP-AVE-00411




